Microscopía e Imagen
Servicios Científico Técnicos
Ofrecemos apoyo técnico y científico personalizado a proyectos de investigación, ya que, aún siendo una herramienta muy potente, para la obtención de resultados óptimos es indispensable una buena preparación de la muestra, conocer bien las posibilidades que ofrecen los equipos, saber cuál de ellos es el indicado para cada tipo de estudio y optimizar su aplicación. Incluye:
- Asesoramiento en los proyectos
- Diseño experimental
- Formación en el procesado de muestras
- Formación en el manejo de equipos
- Interpretación de resultados
- Soporte en la presentación y escritura de resultados para publicación
Nuestros equipos permiten
- Visualización celular: campo claro (BF), contraste de fases (Ph) y contraste diferencial interferencial (DIC).
- Microscopía de Fluorescencia: presencia/ausencia o localización de un antígeno y/o compartimento celular mediante fluoróforos o sondas fluorescentes. Posibilidad de visualización por epifluorescencia (visualización global de la muestra) o por microscopía confocal (visualización de secciones ópticas de la muestra).
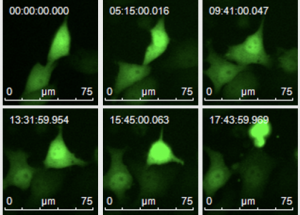
- Seguimiento celular “ex vivo” a tiempo real: posibilidad de capturar imágenes a lo largo de una secuencia temporal.
- Análisis de imagen.
Microscopía e Imagen forma parte de la Plataforma de Terapias Avanzadas del IACS
Servicios
- Visualización Celular
- Microscopía de Fluorescencia
- Seguimiento celular “ex vivo” a tiempo real
- Inmunocitoquímica y Ánalisis de Imagen
- Materiales y Reactivos_Listado_2024 (pdf)
Equipamiento
Vacío
Microscopio confocal Zeiss LSM 880 con Airyscan y Fast Airyscan
El LSM 880 es un microscopio de barrido láser confocal espectral que posibilita una microscopía de gran resolución (en X, Y y Z) con gran velocidad de adquisición, ofreciendo así una altísima sensibilidad y versatilidad.
DETECTORES
El LSM 880 dispone de una unidad interna de detección espectral, Quasar, de alta sensibilidad con un detector central calibrado de 32 elementos de tecnología GaAsP dispuestos en matriz. Este sistema es capaz de capturar todas las longitudes de onda en el rango comprendido de 400 a 750 nm en pasos de 3 nm. La tecnología GaAsP tiene una mayor eficiencia cuántica (>45%) que los detectores PMT tradicionales en una gran parte del espectro y ofrece la posibilidad de trabajar en modo “photon counting”. Este aumento de la sensibilidad minimiza la exposición de la muestra al láser (disminuyendo el “photobleaching”) manteniendo la relación señal/ruido (SNR). Para completar este detector, el LSM 880 incluye dos detectores PMT que trabajan en el rango de detección del azul y del rojo.
Para la detección de luz transmitida el sistema incorpora un detector (T-PMT) que puede ser usado con la iluminación láser para la obtención de imágenes no confocales.
AIRYSCAN (ALTA RESOLUCIÓN)
El sistema incorpora un sistema de alta resolución que utiliza la tecnología GaAsp, denominado Airyscan, el cual está basado en 32 elementos ópticos dispuestos en forma de panal de abeja con el que es posible aumentar la resolución de las imágenes mucho más allá de la resolución de un clásico microscopio de escaneo de punto confocal. Resolución máxima (con una longitud de onda de 488 nm): hasta 140 nm en resolución lateral (XY), y 400 nm en resolución axial (Z).
En el modo rápido (Fast Airyscan), el haz de excitación se alarga en la dirección Y, y el detector Airyscan adquiere 4 líneas de información de imagen simultáneamente ofreciendo así una combinación de alta velocidad (hasta 27 frames/sg a 480 × 480 píxeles), con alta resolución y alta sensibilidad.
Además, Airyscan se puede utilizar como detector confocal “convencional” con tecnología GaAsP (además del detector central).
El módulo Airyscan tiene las siguientes combinaciones de filtros de emisión:
- BP 420-480 + BP 495-550
- BP 495-550 + LP 570
- BP 570-620 + LP 645
- BP 420-480 + BP 495-620
- BP 465-505 + LP 525
- BP 420-445 + BP 465-505
LÁSERES
El módulo láser del LSM 880 está equipado con 4 láseres que generan 6 líneas láser: diodo láser de 405 nm; láser de argón multilínea (longitudes de onda de 458 nm, 488 nm y 514 nm); láser DPSS de 561 nm; y láser HeNe de 633 nm.
MICROSCOPIO
- Estativo Zeiss Axio Observer Z1 con Definite Focus2 (sistema de corrección de foco basado en un LED de 850 nm con una lente motorizada y un sensor CMOS que asegura el mantenimiento del foco compensando cualquier posible deriva producida durante un ensayo time lapse).
- Platina motorizada en XYZ que permite la ejecución de experimentos multi-posición y la creación de mosaicos.
- Inserto piezoeléctrico en la platina para un control y ajuste más preciso y rápido a lo largo del eje Z.
- Lámpara HXP120 de metal haluro como sistema de iluminación de fluorescencia para visualización por oculares. Cubos de fluorescencia disponibles:
- Dapi (ex. 365nm; em. BP 455/50) (Set 49 Zeiss)
- FITC/GFP/Alexa Fluor 488 (ex. BP 470/40; em BP525/50) (Set 38 Zeiss)
- mCherry/Rhodamin/Cy3 (ex. BP 545/25; em. BP 605/70) (Set 43 Zeiss)
- Cy5/Alexa Fluor 647/ToPro 3 (ex. BP 640/30; em BP 690/50) (Set 50 Zeiss)
- Sistema de incubación para ensayos con célula viva. Incluye: cámara interna sobre platina para el control de temperatura, CO2, O2 (en experimentos de hipoxia) y humedad; y cámara de incubación XL, que permite mantener todos los componentes del estativo a la misma temperatura, minimizando así las posibles derivas que pudieran originarse debido a la diferencia de temperatura entre la muestra y los componentes ópticos del microscopio.
- Sistema de protección contra derrames Agua Stop II.
OBJETIVOS
- Plan-Apochromat 10x/0,45 aire (DT 2,1mm); DIC
- Plan-Apochromat 20x/0,8 aire (DT 0,55mm); DIC
- LCI Plan-Apochromat 25x/0,8 multi-inmersión aceite/agua/glicerol (DT 0,57mm); DIC
- Plan-Apochromat 40x/1,3 inmersión en aceite (DT 0,2mm); DIC
- Plan-Apochromat 63x/1,4 inmersión en aceite (DT 0,19); DIC
- LCI Plan-Neofluar 63x/1,3 inmersión en glicerol (DT 0,15-0,19); DIC
- Plan-Apochromat 100x/1,40 inmersión en aceite (DT 0,49); DIC
SOFTWARE
Las imágenes confocales y de Airyscan se realizan utilizando el software Zen Black 2.3, que incluye el módulo “Experiment Designer” para configurar experimentos avanzados de tiempo en bloques con diferentes parámetros de adquisición.
Las imágenes de widefield se realizan utilizando el software Zen Blue 2.3
APLICACIONES
El microscopio confocal espectral Zeiss LSM880 permite la adquisición de imágenes fluorescentes multicanal en muestras vivas. El detector espectral junto con la aplicación del software “spectral unmixing” permiten separar la información espectral de los fluorocromos superpuestos en tiempo real, siempre que estén disponibles los espectros de referencia para cada uno de los fluoróforos individuales. El detector espectral también se puede utilizar para imágenes convencionales de fluorescencia multicanal. La alta sensibilidad del detector permite la detección de señales fluorescentes débiles mientras se emplean bajos niveles de iluminación láser. Por otro lado, el sistema de incubación permite mantener las muestras vivas en las condiciones de temperatura, humedad y CO2/O2 adecuadas para cada tipo celular.
Aplicaciones: reconstrucción 3D/4D y animación; escaneo espectral; análisis y cuantificación de co-localización; separación espectral; time lapse; creación de mosaicos y photo-bleaching (FRAP, FRET; FLIP).
Microscopio Widefield Lapse Leica AF6000 LX
Leica AF6000 LX es un sistema integrado para imágenes y análisis avanzados de widefield en campo claro y fluorescencia. La estación de trabajo permite a los investigadores obtener imágenes de células vivas en condiciones casi fisiológicas, lo que les permite comprender mejor los procesos y la dinámica celular. Funciona con el software LAS X.
El sistema está equipado con una cámara Leica DFC 9000 GT: sensor sCMOS con alta eficiencia cuántica en todo el espectro de luz, que proporciona una alta relación señal/ruido para detectar de manera segura incluso señales débiles. En combinación con un nivel de ruido muy bajo, esto da como resultado una señal de fluorescencia nítida contra un fondo oscuro, un efecto muy deseado en las imágenes de células vivas de fluorescencia de alta gama. Tamaño del sensor 13,3 x 13,3 mm con un tamaño de píxel de 6,5 μm x 6,5 μm (2048 x 2048; 4,2 MP). Esta cámara es rápida, tiene una buena sensibilidad y permite una alta resolución debido al pequeño tamaño de píxel.
Filtros disponibles en el sistema: A4 (ex. 360/40; em. 470/40); L5 (ex. 480/40; em. 527/30); N3 (ex. 546/12; em. 600/40); y BGR (filtro triple azul-verde-rojo). Por otro lado, el sistema tiene una rueda de filtro rápido (cambio de filtro rápido y vibración mínima, lo que resulta en una imagen muy precisa) que, combinado con el bloque de filtro dicroico triple, ofrece los siguientes espectros excitación/emisión: UV (ex. 387/11; em. 457/22); AZUL (ex. 494/20; em. 530/20); y AMARILLO (ex. 575/25; em. 628/28).
Objetivos disponibles:
- 5x/0,12 aire (DT 14,1 mm); BF, Fluo
- 10x/0,25 aire (DT 17,6 mm); BF, Ph, Fluo
- 20x/0,50 aire (DT 1,15 mm); BF, Ph, DIC, Fluo
- 40x/0,75 aire (DT 0,40 mm); BF, DIC, Fluo
- 63x/1,30 inmersión en glicerol, corregido para trabajar a 37°C (DT 0,28 mm); BF, DIC, Fluo
- 100x/1,40 inmersión en aceite (DT 0,09 mm); BF, Ph, DIC, Fluo
El sistema dispone de una cámara de incubación XL que permite regular la temperatura de 22°C a 37°C, así como mantener las condiciones de humedad y CO2 necesarias para el desarrollo celular.
Por otro lado, para llevar a cabo experimentos de perfusión (flujo de medio de cultivo), el sistema está equipado con una bomba peristáltica MINIPULS ®3 de Gilson con 4 canales:
- caudales estándar: 0,3 µL/min a 30 ml/min a una presión máxima de 0,5 MPa
- altos caudales: 1 ml/min a 220 ml/min a una presión máxima de 0,3 MPa
Objetivos disponibles:
- HCPL FLUOTAR 10x/0,30 aire
- HCPL FLUOTAR 20x/0,50 aire
- HCX PL APO 40x/1,25 inmersión en aceite
- HCX PL APO 63x/1,40 inmersión en aceite
- HCX PL APO 100x/1,40 inmersión en aceite
El software LCS incluye representación de volumen en 3D, animaciones 3D, filtro 3D, imágenes estéreo y animaciones, proyección promedio, proyección máxima, SFP; Co-localización (citofluorogramas en 2D y 3D).
Se permite el manejo en régimen de autoservicio, siempre que el usuario cumpla los requisitos de formación y experiencia establecidos.

Microscopio Widefield invertido Olympus IX81
Microscopio de fluorescencia Olympus IX81 de óptica invertida con cámara digital Olympus XC50 y lámpara de fluorescencia de metal haluro. Permite la adquisición de imágenes de fluorescencia y/o iluminación transmitida (BF y Ph) en cultivos y/o células fijadas y cortes de tejidos animales y vegetales.
Filtros de fluorescencia disponibles: U-MNUA2 (excitación 360-370; emisión 420-461),
U-MNIBA3 (excitación 470-495; emisión 510-550) y U-MNIGA3 (excitación 540-550; emisión 575-625).
Objetivos disponibles:
- UPLFLN 4x/0,13 aire (DT 17 mm); BF, Fluo
- UPFLN 10/0,3 aire (DT 10 mm); BF, Ph, Fluo
- LUCPLFL 20x/0,45 aire (DT 6,4-7,6 mm); BF, Ph, Fluo
- LUCPLFL 40x/0,60 aire (DT 2,7-4,0 mm); BF, Ph, Fluo
- UPLFLN 60x/0,65-1,25 inmersión en aceite (DT 0,2mm); BF, Ph, Fluo.
Se permite el manejo en régimen de autoservicio, siempre que el usuario cumpla los requisitos de formación y experiencia establecidos.

Laboratorio de inmunofluorescencia
La inmunofluorescencia es una técnica de inmunomarcación que hace uso de anticuerpos unidos químicamente a una sustancia fluorescente para demostrar la presencia de una determinada molécula.
La inmunofluorescencia, como técnica de tinción, puede ser utilizada en cortes de tejidos, líneas celulares cultivadas, y células individuales, con la finalidad de analizar la presencia y distribución de proteínas, glúcidos y moléculas pequeñas tanto de origen biológico como no. Esta técnica puede ser utilizada en combinación con otras técnicas de coloración fluorescente que no hagan uso de anticuerpos, como por ejemplo DAPI para marcar DNA.
El investigador deberá aportar cultivos celulares crecidos sobre placas o sobre cubreobjetos, o cortes de tejido ya desparafinados y adheridos al portaobjetos.
La manipulación por el usuario está admitida, y existe a disponibilidad del mismo un stock de anticuerpos para llevar a cabo la inmunofluorescencia (consultar).
Se entregarán muestras procesadas en función del material de partida.

Más información
Próximos eventos de los SCT
Formación específica en anastomosis intraabdominales e instrumentación quirúrgica8 mayo | 9:00 am - 8:00 pm
Noticias de los SCT
El SCT de Secuenciación y Genómica Funcional organiza un seminario para conocer las aplicaciones del nuevo equipamiento Chromium iX
El SCT ha adquirido un equipo de 10X Genomics para la preparación de librerías de NGS a partir de célula única, que permite, partiendo de un disgregado celular, medir la expresión génica de cada una de las células por separado, lo que supone una revolución en la secuenciación del transcriptoma
El SCT de Microscopía e Imagen abre el plazo para solicitar el servicio de chequeo de muestras
La solicitud de esta técnica/servicio se podrá realizar hasta el 15 de enero de 2024 para el año completo o entre el 1 y el 15 de julio para el segundo semestre del año.
Visita virtual
Si quieres visitar más instalaciones del CIBA, accede a la visita virtual de Ciencia Abierta 24 horas.
Contacto SCT Microscopía e Imagen
Centro de Investigación Biomédica de Aragón (CIBA). Planta A
Avda San Juan Bosco 13, 50009, Zaragoza
Tfno 976 71 3810
Técnico de Área:
María Royo Cañas
Tfno. (+34) 976 713810
mroyo.iacs@aragon.es
Técnico de laboratorio:
César Vallejo Ruiz
Tfno. (+34) 976 71 3783
cvallejor.iacs@aragon.es